Контроль якості в медичних лабораторіях
Огляд рекомендацій LABAC щодо проведення контролю якості та подальших дій в медичних лабораторіях
Імплемпентація вимог стандарту ISO 15189:2012 ставить перед лабораторією складне завдання планування та проведення внутрішньолабораторного контролю якості досліджень. Цінним джерелом досвіду роботи акредитованих за ISO 15189:2012 лабораторій є Рекомендації LABAC (Франція) щодо проведення контролю якості та подальших дій у медичних лабораторіях, що опубліковані французькою мовою у журналі Annales de Biologie Clinique (2019р).
Рекомендації, запропоновані у цьому документі, є результатом роботи, проведеної спільно з Мережею акредитованих медичних лабораторій (LABAC), Французьким товариством медичної біології (SFBC) та Федерацією асоціацій зовнішньої оцінки якості (FAEEQ). Описано різні етапи впровадження контролю якості на основі аналізу ризиків, оцінку змін партій реагентів або матеріалів внутрішньолабораторного контролю якості (ВЛКЯ). У документі обговорюються дії, яких необхідно вжити у разі невідповідності результатів ВЛКЯ, вибір схеми зовнішньої оцінки якості (ЗОЯ) та інтерпретація її результатів, а також нові проблемні питання — контроль якості досліджень, що виконуються на кількох автоматичних системах, доступних в одній лабораторії.
Описано концепцію невизначеності вимірювання та надійності методів. Рекомендації LABAC висвітлюють методи внутрішнього контролю якості (ВЛКЯ), зовнішньої оцінки якості (ЗОЯ) та оцінки невизначеності результатів вимірювань (НВ) для рутинних кількісних методів (біохімія, гематологія та гемостаз). Мікробіологічне тестування (включаючи інфекційну серологію) виключено з обсягу цих рекомендацій, а також виключено спеціалізовані тести, до яких слід адаптувати методи контролю якості. Отже, ці рекомендації не стосуються всіх випадків, які можуть трапитися у медичних лабораторіях.
Рекомендації LABAC не претендують на те, щоб реагувати на кожну можливу ситуацію в лабораторії, а покликані вважатися основою для роздумів і практики роботи для всіх, хто займається організацією роботи у медичних лабораторіях.
Також розглядається реалізація альтернативної стратегії, яка є добре аргументованою та об’єктивною. Ці рекомендації, імовірно, з часом будуть змінюватись.
Було запропоновано ТРИ РІВНІ РЕКОМЕНДАЦІЙ:
- Рекомендовані практики (вважається, що відповідають вимогам стандарту ISO 15189:2012): вони отримані з референтних документів, консенсусних даних з різних публікацій або також можуть ґрунтуватися принаймні на одній публікації з надійною методологією та критеріями інтерпретації (думка експертів). Вони представляють найкращі практики, «сучасний рівень» («state of the art»), і можуть бути цілями при впровадженні належної лабораторної практики.
- Прийнятні практики: вони встановлюються з урахуванням різних бібліографічних даних, які піддавалися різним інтерпретаціям у різних публікаціях або, за відсутності цього, публікації, для якої критерії тлумачення не такі сильні, як у рекомендованій категорії (наприклад, менше авторів, статистично використана методологія тощо).
- Неприйнятні практики (вважається, що не відповідають вимогам стандарту ISO 15189:2012). Неприйнятна практика — це підхід, коли після ознайомлення з різними публікаціями прийнятий консенсус, що така практика може поставити під загрозу надійність результатів.
Що стосується ВЛКЯ, стандарт ISO 15189:2012 вимагає наступного:
- розробіть процедури контролю для забезпечення досягнення очікуваної якості результатів;
- використовуйте контрольні матеріали, які максимально схожі на зразки пацієнтів (беріть до уваги комутабельність);
- періодично аналізуйте контрольні матеріали відповідно до стабільності системи;
- у разі невідповідності оцініть вплив на будь-які результати, про які вже повідомлялося з моменту останнього прийнятного ВЛКЯ;
- регулярно переглядайте результати ВЛКЯ, щоб виявити відхилення та тенденції.
Документ визначає концепцію задокументованої стратегії, включаючи визначення серії, частоту використання, використовувані рівні, вимоги до продуктивності та правила перевірки. Він також стосується заходів, яких необхідно вжити у випадку невідповідності, результатів, які не відповідають визначеним правилам, та оцінки можливого впливу на результати, про які вже повідомлялося.
Аналіз ризиків, визначення серій
Аналіз ризиків
Аналіз ризиків є важливим першим кроком у реалізації стратегії ВЛКЯ. Він складається з короткого викладу аналітичних проблем, що можуть призвести до потенційно помилкового результату (Таблиця 1). Наведений нижче перелік не є вичерпним і включає основні виявлені ризики.
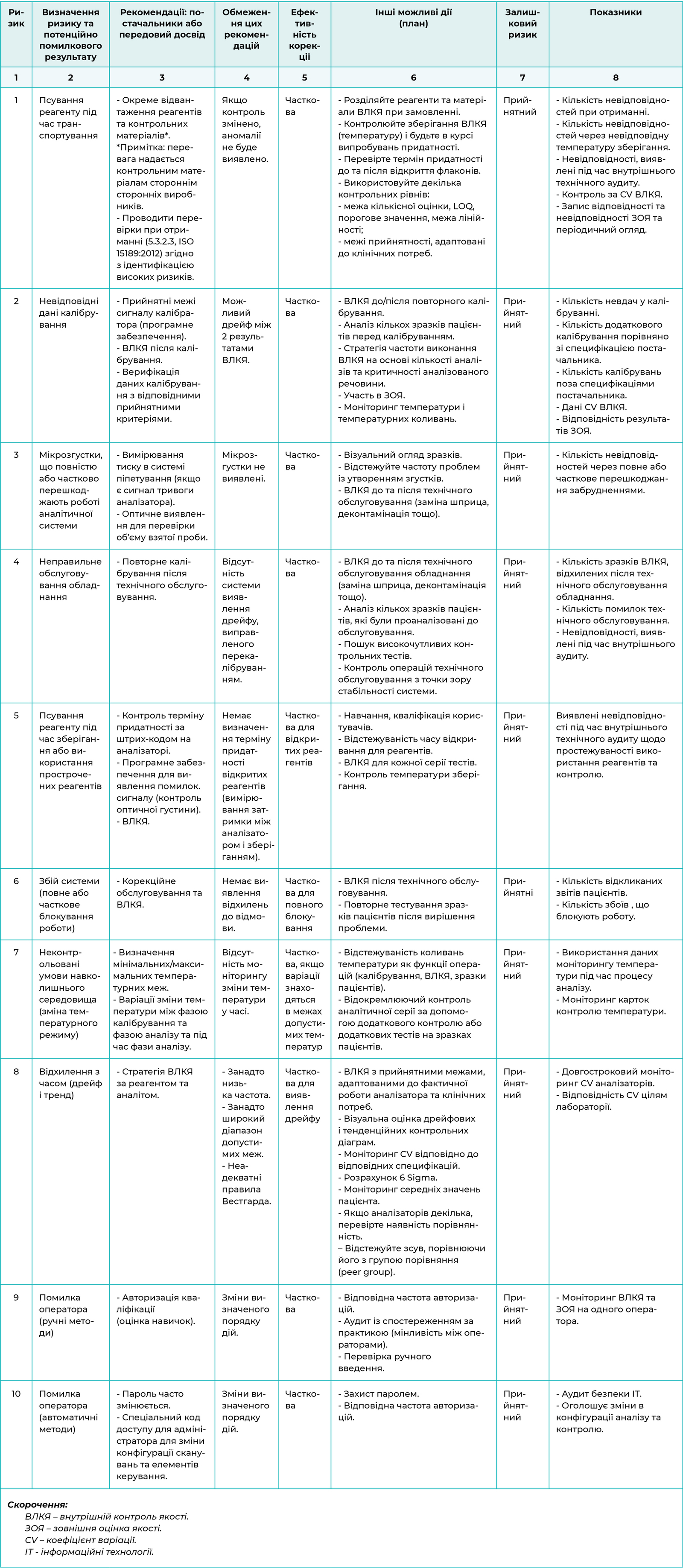

Ці ризики залежать від кожного методу і, здебільшого, ідентифіковані. Постачальники медичних виробів для діагностики in vitro надають контрольні матеріали. Однак ці рекомендації можуть бути недостатніми або невідповідними, і можуть знадобитися подальші дії. Усі ці дії мають бути пов'язані з індикаторами, що дають змогу контролювати ризики шляхом запису ситуацій, коли ризик більше не контролюється (наприклад, моніторинг невідповідностей). У рамках підходу безперервного вдосконалення необхідна повторна оцінка ризику (з новими вхідними даними: невідповідність, внутрішній та зовнішній аудит, скарги, показники тощо) із впровадженням будь-яких нових засобів контролю. Цей «динамічний» підхід дозволяє створити проактивну систему.
Інші ризики можуть бути визначені, зокрема, залежно від використовуваного аналізатора або методу (наприклад, якість витратних матеріалів, якість води тощо). Обов’язком лабораторії є створення відповідних контрольних ресурсів.

Оцінка стабільності (робастності) метода
Стандарт ISO 15189:2012 у 5.6.2.1 визначає, що очікувана якість результатів має бути перевірена. По-перше, необхідно визначити надійність методу (Таблиця 3).

Підхід Six Sigma (Sigma = (TEA - Bias)/CV) не є метою сам по собі, він є інструментом для оцінки надійності методу. Рівень сигма розраховується на основі загальної допустимої похибки (TEA), обраної лабораторією, коефіцієнтів варіації (CVs) і зсувів, які є об’єктивними даними, характерними для методу. Складність полягає у виборі TEA, який може значно змінити результат рівня Sigma. Наразі ведуться дебати щодо формули сигма-розрахунку з урахуванням зсуву.
Для оцінки надійності методу можна використовувати інші засоби: коефіцієнт повторюваності/відтворюваності, частота перекалібровок, частота зміни цільових показників середнього для ВЛКЯ тощо.
Медична лабораторія також може використовувати результати методів групи порівнянь (як підхід правильності), виходячи зі звітів ЗОЯ та, можливо, результати порівнянь з іншими лабораторіями.
Розрахунок Sigma в основному використовується для визначення стратегії ВЛКЯs як частоти аналізів матеріалів контролю якості (КЯ) (Таблиця 3). Підхід Six Sigma підходить для великих серій.
Sigma = (TEA - Bias)/CV, де:
ТЕА — загальна допустима похибка,
CV — коефіцієнт варіації,
Bias — наявний значущий зсув
Стратегія частоти дослідження матеріалів ВЛКЯ: визначення серії та критичних подій
Лабораторія повинна визначити, що може вплинути на стабільність процесу методу. Лабораторія визначає критичні події або критичні контрольні точки (контроль якості критичної контрольної точки): калібрування, технічне обслуговування з безпосереднім впливом на результати (заміна деталей, регулювання тощо), деякі типи несправностей, зміна партії реагентів або калібраторів тощо. Лабораторія може таким чином визначити події, які закінчують аналітичну серію.

Стратегія планування ВЛКЯ заснована на (Таблиця 4):
- визначення частоти використання матеріалів ВЛКЯ (див. табл.1: ризики 2 та 5);
- використовувані рівні (див. табл.1: ризики 1 та 2);
- позиціонування в серії (калібрування, кількість дозування) (див. табл.1: ризики 2 та 7);
- події, які можуть мати вплив (див. табл.1: ризики 2, 3, 4, 6);
- визначення допустимих меж і вибір правил для інтерпретації контрольних карт (див. табл.1: ризики 1, 2, 8).
Для визначення довжини серії слід також враховувати наступне:
- стабільність зразка (аналіз ризику, який проводиться, коли стабільність аналіту не завжди дозволяє повторно тестувати зразок. Наприклад — бікарбонати);
- критичність тесту, якщо результат надається в екстрених випадках (тропонін, D-димер, загальний аналіз крові тощо ) до проведення ВЛКЯ для закриття серії;
- надійність використовуваної техніки;
- рекомендації виробника.
Тому лабораторія відокремлює серію за допомогою ВЛКЯ або інших засобів (Таблиця 3). Тим не менш, «зрештою», після останнього ВЛКЯ, прийнятно вважати, що метод знаходиться під контролем і стабільний протягом відносно короткого часу, який ще буде визначений лабораторією (кілька годин відповідно до досвіду авторів), для обмеженої кількості тестів (менше 50, за досвідом авторів) з урахуванням надійності методу.
Профілактичне обслуговування в графіку ВЛКЯ
Ризик 4. Неправильне обслуговування обладнання (див. табл.1)
Профілактичне технічне обслуговування може вплинути на метод (це буде задокументовано у виробника системи). У таких випадках важливо враховувати всю інформацію, щоб контролювати своє обладнання.
Найпростішим способом моніторингу впливу заходів технічного обслуговування на стабільність системи є виконання ВЛКЯ до та після технічного обслуговування, але лабораторія також може використовувати інші засоби (повторне випробування зразків тощо, таблиця 5).

Ремонт обладнання (невідкладні коригувальні дії)
Ризик 6. Збій системи (повне або часткове блокування роботи) (див. табл.1)
Ремонт обладнання може мати вплив на аналітичні характеристики методу, тому у цьому випадку потрібно достроково закінчити серію вимірювань. Лабораторія повинна перевірити, чи не було дрейфу до виходу обладнання з експлуатаційного стану (дослідження впливу, таблиця 6).

Кількість тестів у серії та частота ВЛКЯ
Ризик 8. Відхилення з часом (дрейф і тренд) (див. табл.1)
Лабораторія повинна визначити частоту ВЛКЯ та розмір серії (кількість аналізів зразків пацієнта на аналіт між двома ВЛКЯ) (Таблиця 7 ). Сигмаметрія є одним із способів (таблиця 4) для оцінки надійності методу, але при аналізі ризику необхідно також враховувати інші елементи:
- клінічне значення аналізу;
- часові рамки оприлюднення та використання результатів;
- можливість повторного аналізу зразків (застосовуються попередні аналітичні вимоги), якщо це можливо (неможливо для деяких тестів, таких як аналіз газів крові).

Деякі автори в останніх публікаціях пропонують адаптувати розмір аналітичної серії відповідно до рівня Sigma і вибору правил Вестгарда.
Вибір контрольних матеріалів для внутрішнього контролю якості
Стандартні вимоги
Ризик 1. Псування реагенту під час транспортування (див. табл.1)
Ризик 2. Невідповідні дані калібрування (див. табл.1)
ВЛКЯ повинні відповідати таким вимогам стандарту ISO 15189-2012 (п. 5.6.2.2):
- матеріали, якомога ближчі до зразків пацієнтів. Незмінюваність ВЛКЯ не є забороненою, якщо вони більш чутливі до аналітичних проблем, ніж зразки пацієнтів (для внутрішньолабораторного моніторингу відтворюваності);
- регулярний огляд результатів відповідно до стабільності методу та ризику впливу на догляд за пацієнтом у разі помилкового результату.
- концентрації контрольних рівнів, близьких до рівнів клінічного рішення.
Незалежний від виробника ВЛКЯ
Стандарт ISO 15189:2012 (п. 5.6.2.2, примітка 2) рекомендує при ВЛКЯ, незалежно від постачальника, контролювати ризик невиявлення зсуву при зміні реагенту (погана сумісність або помилкові відкидання серій). Однак, якщо в аналізі бере участь виробник аналітичної системи, для критичного аналізу потрібен ВЛКЯ виробника (Таблиця 8).

Кількість і рівні концентрації
Необхідно також визначити кількість і рівні концентрації ВЛКЯ: ВЛКЯ має досліджувати весь діапазон вимірювань, а також межі клінічного рішення. Він також повинен дозволяти перевірити калібрування (Таблиця 9).

Контрольні ліміти та межі прийнятності
Ризик 8. Відхилення з часом (дрейф і тренд) (див. табл. 1)
Основна мета — виявити аномалії та тенденції (зсув і дрейф) і перевірити, чи досягають результати необхідної якості.
Межі прийнятності (термін «специфікація аналітичної ефективності» використовується в останніх європейських рекомендаціях) слід вибирати на основі фактичної ефективності методу для виявлення тенденцій, зрушень або відхилень.
Будьте обережні, щоб не переплутати тренд і зсув.
Тренд — це постійне збільшення (або зменшення) результатів.
Зсув — відповідає постійному відхиленню від середнього.
Лабораторія визначає свої CV для кожного аналіту (див. п. 5.6.2.1. ISO 15189:2012) відповідно до аналітичних характеристик попередніх партій. Ці CV є власними CV лабораторії: довгострокові CV (CVLT), які визначаються з урахуванням усіх джерел варіабельності методу.
Вони використовуються для визначення допустимих меж для контрольних карт.
На другому етапі, щоб контролювати роботу лабораторії, необхідно буде порівняти отримані CV з референтними, які можуть бути:
- CV, отримані у результаті оцінки біологічної варіації, що є у базі даних Європейської федерації лабораторної медицини (EFLM) як результати Європейського дослідження біологічних варіацій (EuBIVAS);
- CV, що повідомлені виробником;
- CV від груп порівняння (екстерналізований ВЛКЯ);
- CV на основі рекомендацій фахових спілок;
- CV з рекомендацій постачальників ЗОЯ.
Скорочення:
- EFLM — European Federation of Clinical Chemistry and Laboratory Medicine, Європейської федерації лабораторної медицини.
- EuBIVAS — European Biological Variation Study, Європейського дослідження біологічних варіацій.
Використання правила Вестгарда та інших
Точка зору, представлена в Таблиці 10, дозволяє лабораторії гарантувати, що аналітичні показники залишаються стабільними та під контролем. Ця пропозиція не враховує вплив на клінічні показники (або відсутність впливу) у разі неприйнятних аналітичних показників (див. дослідження впливу після ВЛКЯ, кінець серії за межами прийнятних меж).

Додаткову інтерпретацію можна застосувати для оцінки потенційного клінічного впливу. Таким чином, існує два рівні оцінки: аналітичні прийнятні межі та допустимі межі, пов’язані з медичним ризиком.
Контрольні правила
Цілями використання правил Вестгарда є:
- виявлення систематичної або випадкової помилки аналізу;
- припинити видачу результатів у разі доведеної помилки;
- оцінити помилку, викликану раніше виданими результатами, щоб оцінити вплив на пацієнта та з точки зору статистики, цілі полягають у тому, щоб отримати:
- ймовірність виявлення помилки (PED) більше 90 %: це міра ймовірності виявлення помилки, якщо є проблема з методом аналізу; ця ймовірність повинна бути якомога вищою;
- ймовірність помилкового відхилення (PFR) менше 5 %: це відповідає ризику відхилення серії за відсутності будь-яких проблем із методом аналізу; ця ймовірність повинна бути якомога нижчою.
Деякі міжнародні рекомендації дозволяють вибрати, як мінімум, правила відхилення без урахування надійності методу (ризик перевищення якості, Таблиця 11)

Сучасні правила Вестгарда адаптовані до довжини аналітичної серії та відповідно результатів сигмаметрії та ймовірностей виявлення помилок (Рисунок 1):
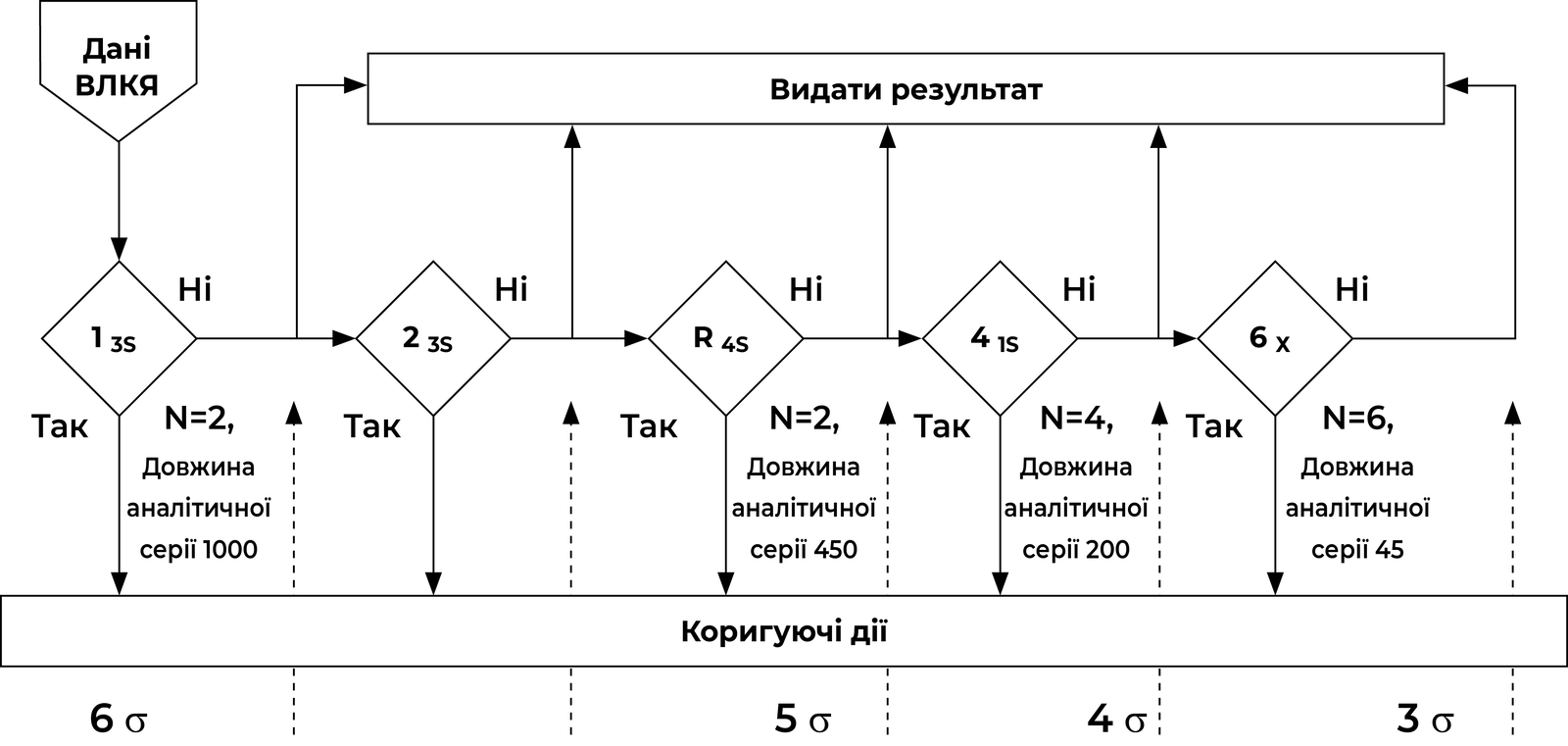
Sigma Метрика = (% ТЕА – % Bias) / % CV
Експоненціально зважена ковзна середня (EWMA)
Щоб покращити виявлення малих тенденцій, у 1959 році Робертс запропонував експоненціально зважену ковзну середню (EWMA) на основі байєсівської статистики. Принцип EWMA простий: кожне нове значення ВЛКЯ зважується попередніми значеннями. Це метод згладжування нових результатів, отриманих за допомогою експоненціально зваженої ковзної середньої, тобто надає перевагу останнім точкам за рахунок старих. На практиці це дозволяє раніше виявляти невеликі відхилення та краще виявляти систематичні помилки.
Скорочення:
- EWMA — Exponentially Weighted Moving Average, експоненціально зважена ковзна середня.
- LOQ — Limit of quantification, Межа кількісної оцінки.
*У наступному номері «Лабораторна справа» читайте продовження Рекомендацій LABAC про використання ВЛКЯ для верифікації нового лоту реагентів, дії при отриманні неприйнятних результатів контролю.







